面对浩瀚优质文章在 Frontiers 的不断发表,而你可能由于种种原因错过了。为此,“主编荐读” 集合了 Frontiers 众多期刊近期发表的优质文章,由各期刊编委汇总选送。
本期由目前担任 Frontiers in Cell and Developmental Biology (IF: 5.5 | CiteScore: 6.3) 期刊 Signaling 栏目主编的张志刚教授,对近期发表在该栏目下的部分文章进行了推荐及点评,此为上卷,欢迎阅读。

张志刚教授,研究员,博士生导师。上海交通大学肿瘤研究所癌基因及相关基因国家重点实验室,神经递质与肿瘤微环境研究团队负责人。中国生理学会基质生物学专业委员会主任委员,中国医师协会精准医疗委员会癌症代谢与治疗委员会副主任委员。获得十二五国家科技重大专项,国家自然科学基金重大研究计划、国家自然科学基金面上项目、国家高技术研究发展计划(863 计划)等课题资助。担任 Frontiers in Cell and Developmental Biology, Signaling section 主编,Journal of Immunology Research 客座主编。以通讯作者在消化系统主流期刊 Gastroenterology,Gut,NatureCommunications,Hepatology,Journal of Hepatology,American Journal of Gastroenterology,Genome Biology,Clinical Cancer Research,Cancer Research,Oncogene 等发表多篇论文。上海市领军人才,上海市优秀学科带头人,上海市卫生系统优秀学科带头人,上海交通大学医学院“高原高峰”计划。申请国家发明专利 9 项,获国家专利授权 6 项,获国际 PCT 专利授权 1 项,参与编写中英文专著 2 本。获上海医学科技二等奖(第一完成人)。
其研究方向主要集中在:肿瘤的系统性调控、神经递质-激素-免疫系统对肿瘤发生发展的调控、器官间交流在肿瘤发生发展中的作用。
OPA1 通过内质网-线粒体耦合调节线粒体对钙离子的吸收
OPA1 Modulates Mitochondrial Ca2+ Uptake Through ER-Mitochondria Coupling
文章导读:常染色体显性遗传视神经萎缩(Autosomal Dominant Optic Atrophy,ADOA)是一种导致失明和其他神经系统障碍的疾病,与 OPA1 基因突变相关。OPA1 的 GTPase 和 GED 结构域在调控线粒体内膜(IMM)的融合和脊髓结构的组织方面发挥着重要作用,这些过程对于细胞的氧化代谢至关重要。线粒体动态变化和膜结构的组织也与钙离子稳态和信号传导有关,但 OPA1 在钙离子动态中的具体作用尚未确立。
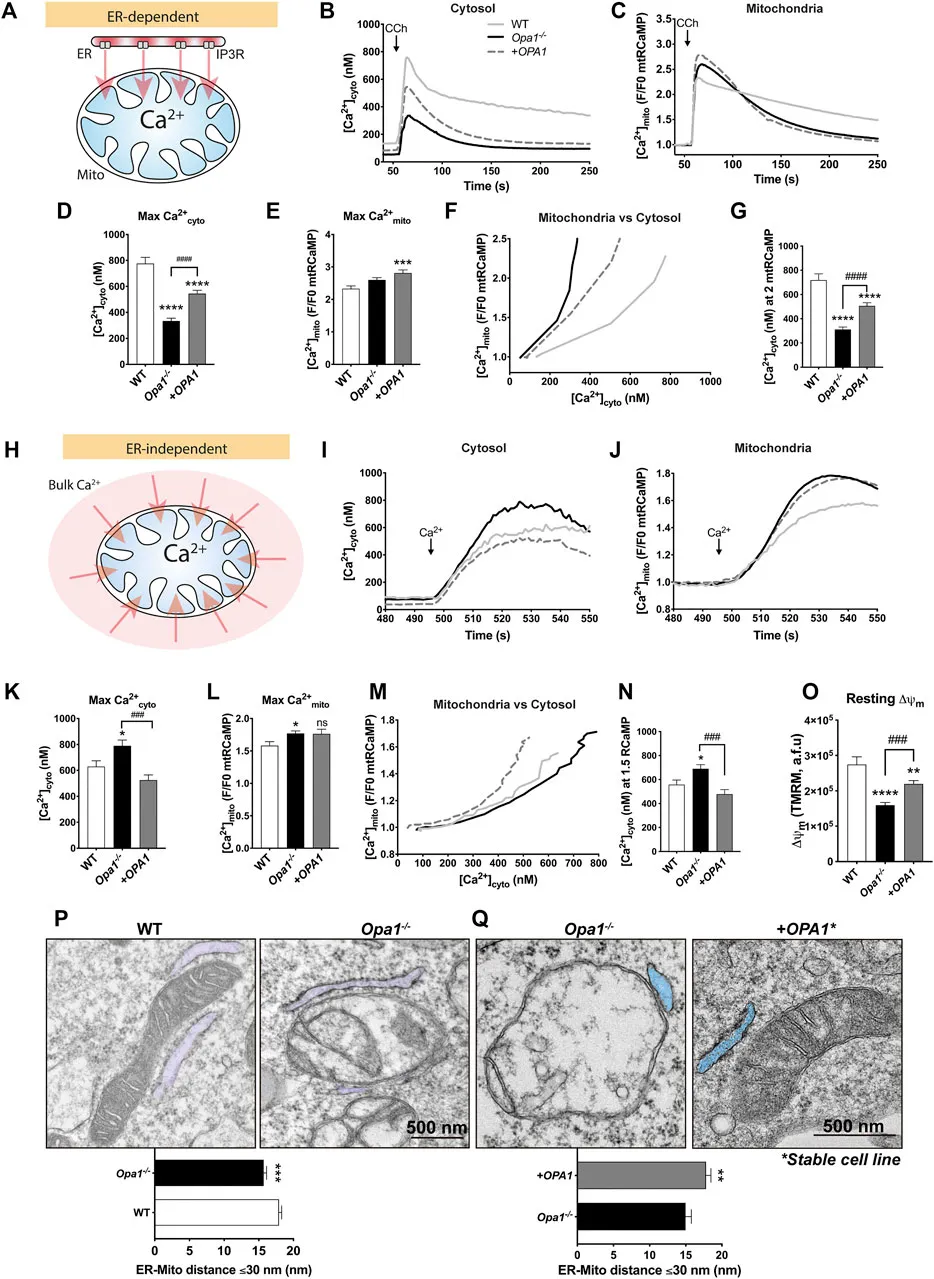
OPA1 是细胞质和线粒体 Ca2+ 稳态所必需的
本研究分别在 OPA1 缺陷和野生型小鼠胚胎成纤维细胞(MEFs),以及源自 ADOA 患者的人类纤维细胞中,采用了拯救(rescue)和过表达(overexpression)策略,研究了 OPA1 及其与 ADOA 相关的突变对钙离子稳态可能造成的影响。缺少 OPA1 的 MEFs ,只需较少量从内质网(ER)释放的 Ca2+ ,即可诱导线粒体基质中的钙离子升高。这与内质网- 线粒体的更紧密接触有关,但线粒体钙离子通道复合物含量并无明显变化。携带 OPA1 GTPase 或 GED 结构域突变的患者细胞也显示出改变的钙离子稳态,而这些与较低 OPA1 水平相关的突变同样表现为内质网-线粒体之间的更紧密接触。此外,在 OPA1 缺失的情况下,急性表达 OPA1 GTPase 突变体但不是 GED 突变体,部分恢复了 MEF 细胞质中促使线粒体内钙离子升高所需的钙离子浓度。最后,在野生型小鼠胚胎成纤维细胞中过度表达 OPA1 突变体扰乱了钙离子稳态,部分重现了在 ADOA 患者细胞的观察结果。
因此,OPA1可能通过其 GED 结构域调节功能性的内质网-线粒体耦合。然而在患者中,正常和突变形式的 OPA1 并存会导致钙离子稳态失衡,并非受制于特定的结构域,这可能会影响 ADOA 病情的整体进展。
原文链接👇
脓毒症对高密度脂蛋白代谢的影响
Impact of Sepsis on High-Density Lipoprotein Metabolism
文章导读:在这项研究中,研究人员探讨了高密度脂蛋白(HDL)在脓毒症中的保护作用及其与脂蛋白代谢酶的关系。HDL 以多种方式发挥着保护作用,例如促进类固醇合成、清除细菌毒素、保护内皮屏障以及抗氧化/抗炎活性。然而,在脓毒症患者中,HDL 水平却迅速下降,但造成这种现象的机制还不清楚。
为了解决这个问题,研究人员在重症监护病房(ICU)的脓毒症和非脓毒症患者中,研究了与脂蛋白代谢有关的酶。结果表明,在 53 名脓毒症患者和 25 名非脓毒症患者中,涉及脂蛋白代谢的多个酶存在显著差异。具体来说,脓毒症患者中的某些酶活性显著降低,如卵磷脂胆固醇酰基转移酶(LCAT)活性、LCAT 浓度以及胆固醇酯转运蛋白(CETP)活性。与此同时,脓毒症患者中的其他酶活性却显著增加,如磷脂转运活性蛋白(PLTP)和内皮脂酶(EL)。此外,血清淀粉样蛋白A(SAA)水平在脓毒症患者中比非脓毒症患者增加了 10 倍。

ICU 对照组(没有败血症或菌血症的患者)和 ICU 败血症组的箱形图
更重要的是,研究还发现 LCAT 活性与 ICU 入院和 28 天死亡率显著相关,而作为强烈的炎症标志物,SAA(血清淀粉样蛋白A)水平与死亡率无关。总之,这项研究提供了有关脓毒症期间 HDL 代谢迅速且显著变化的新数据。研究结果明确强调了特定代谢途径和酶在脓毒症的病理生理中扮演的关键作用,这一发现可为未来的新疗法提供重要线索。
原文链接👇
不同的 PINK1 磷酸化事件对 MFN2 介导的线粒体自噬和线粒体融合的相互调控
Reciprocal Regulation of Mitofusin 2-Mediated Mitophagy and Mitochondrial Fusion by Different PINK1 Phosphorylation Events
文章导读:线粒体修复对于代谢稳态发挥着重要作用。线粒体融合蛋白(MFN)协调线粒体的融合,从而抵御细胞衰老引起的线粒体退化。MFN2 的活动取决于不同的生理环境,它既可以介导线粒体融合,也可以招募细胞质中的 Parkin 来启动线粒体自噬。由于目前尚不清楚这些事件是如何相互调控的,该课题的研究人员构建并表达了模拟在 PINK1 磷酸化位点(T111、S378 和 S442)被磷酸化或不可磷酸化的线粒体融合蛋白-2(mitofusin-2,MFN2)突变体。
通过研究线粒体融合、极化状态以及被可能由于MFN2 磷酸化标记而存在的 Parkin 结合或者线粒体自噬,课题组发现,个别的 MFN2 磷酸化事件就如同一个生物学“条码”,根据磷酸化位点的状态,决定线粒体的命运。缺乏 PINK1 的细胞实验结果支持了 PINK1 激酶调控 MFN2 功能的关键作用。与 Parkin 介导的泛素化调节了 MFN2 介导的线粒体融合这一常见观点相反,Prkn 缺陷细胞的实验证明了 MFN2 的失活无需 Parkin 的存在。这些数据表明,由 PINK1 介导的磷酸化已经足够将 MFN2 从融合蛋白切换为线粒体自噬效应器,并不需要 Parkin 参与其中。
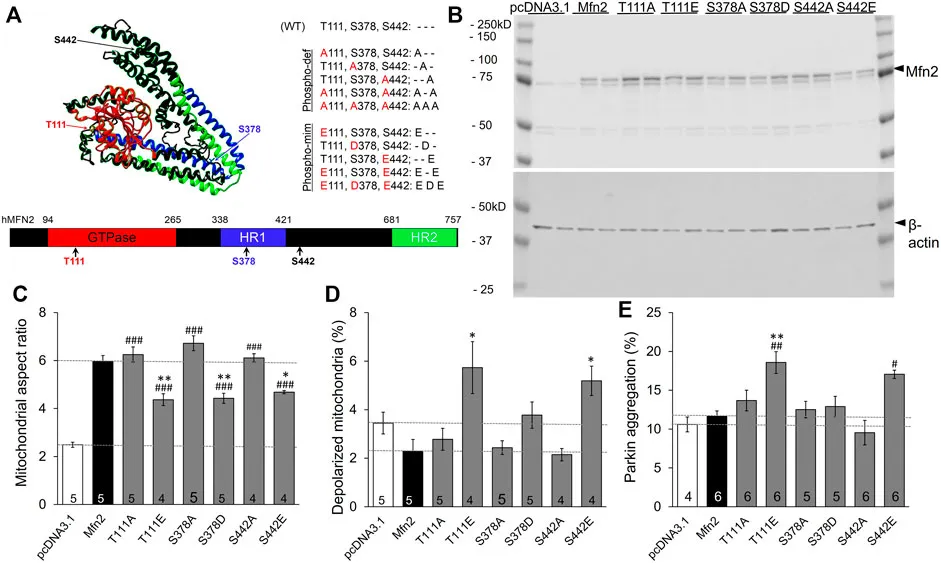
单个PINK1磷酸化位点状态对MFN2调制线粒体终点的影响
更重要的是,研究还发现 LCAT 活性与 ICU 入院和 28 天死亡率显著相关,而作为强烈的炎症标志物,SAA(血清淀粉样蛋白A)水平与死亡率无关。总之,这项研究提供了有关脓毒症期间 HDL 代谢迅速且显著变化的新数据。研究结果明确强调了特定代谢途径和酶在脓毒症的病理生理中扮演的关键作用,这一发现可为未来的新疗法提供重要线索。
原文链接👇
![]() Frontiers in Cell and Developmental Biology 是聚焦于细胞与发育生物学领域基础生命科学问题的开放获取期刊,创刊于2013年。期刊最新影响因子为 5.5,CitesScore 为 6.3。期刊涵盖了细胞生物学、遗传与发育、癌症研究以及干细胞等多个医学基础研究的前沿领域,旨在更好的理解机体各类细胞在各种生理及病理状态下的相关机制和作用,从而促使人类找的新的疾病治疗方案。
Frontiers in Cell and Developmental Biology 是聚焦于细胞与发育生物学领域基础生命科学问题的开放获取期刊,创刊于2013年。期刊最新影响因子为 5.5,CitesScore 为 6.3。期刊涵盖了细胞生物学、遗传与发育、癌症研究以及干细胞等多个医学基础研究的前沿领域,旨在更好的理解机体各类细胞在各种生理及病理状态下的相关机制和作用,从而促使人类找的新的疾病治疗方案。

Frontiers 是全球第六大出版社,文章被引用次数位列全球第三。Frontiers 总部位于瑞士,是全球领先的开放获取(Open Access)出版商,致力于使科学在全球范围内更加开放,其发布的研究文章已被浏览超过 24 亿次。欲了解更多详情,欢迎访问 Frontiers 官方网站:www.frontiersin.org.

